Annexin V-FITC/PI雙染檢測細胞凋亡
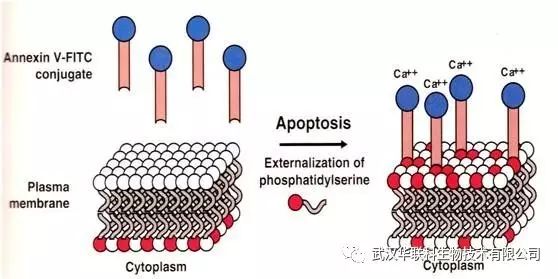
正常細胞膜磷脂的分布是不對稱的,膜內表面含負電的磷脂(如磷脂酰絲氨酸,PS),而膜外表面含有占絕大多數的中性磷脂。在細胞凋亡的早期,細胞膜內的PS會從內側翻轉到細胞膜表面。
Annexin V是一種鈣依賴性磷脂結合蛋白,能與PS高親和力特異性結合。
PI是一種核酸染料,它不能透過完整的細胞膜,而早期凋亡細胞的細胞膜是完好的,對PI有拒染性。但在凋亡中晚期的細胞和死細胞,PI能透過細胞膜而使細胞核染上。
因此Annexin V 和PI同時使用,可以將凋亡早期的細胞與其它細胞區別開來。
實驗步驟
細胞凋亡(Annexin V-FITC/PI染色)適用于:細胞未轉染GFP或未使用紅色藥物。
1.收集細胞:包括漂浮在培養基上的細胞;之后,須把EDTA洗去,PBS或培養基重懸送樣,正常組細胞分出200μl體積不染色;
2.離心:1000轉/分,5分鐘,棄上清;
3.重懸:加入200μl Binding Buffer,混勻;
4.染色:加入5μl Annexin V-FITC,室溫避光孵育10分鐘;
5.離心:1000轉/分,5分鐘,棄上清;
6.重懸:加入200μl Binding Buffer,混勻;
7.染色:加入5μl PI,直接上機。
注意事項
1.包括漂浮在培養基上的細胞,一起收集;
2.洗細胞后,建議輕輕搖勻細胞沉淀,避免使用加液槍,以免由于塑料槍頭的使用造成細胞損失;
3.一次檢測很多樣本,加入PI應該有一定的時間間隔(一般以30~60s為宜),因為PI本身有毒。
對照組凋亡比例高的原因
1.細胞狀態不好;
2.細胞收集后存放的時間太長,沒有及時染色;
3.細胞表面原有的PS相對較多,應選用低濃度的AnnexinV標記;
4.PBMC表面往往有血小板黏附在細胞表面,造成Annexin V陽性率偏高;
5.過分吹打、震蕩或胰酶消化等,可能使PS暴露出來。
處理組凋亡比例低的原因
1.凋亡刺激得不夠;
2.細胞本身生長狀態可能對刺激因素不敏感,如過度增殖的細胞對凋亡的誘導不太敏感;
3.Annexin V的結合緩沖液失效,應4 ℃保存;
4.貼壁細胞消化時間過長,膜表面的PS受損,Annexin V結合位點減少。


