動物模型構建
短腸綜合癥指的是在小腸廣泛切除或曠置后,腸道有效吸收面積顯著減少,殘存的功能性腸管不能維持患者的營養,以至于出現以腹瀉、酸堿、水、電解質紊亂以及各種營養物質吸收和代謝障礙為主要臨床癥狀的癥候群。SBS是成人慢性腸衰竭的最常見的病因,由于部分患者的剩余腸道不能滿足機體代謝和營養的需求,不得不長期依賴腸外營養的補充,但長期使用腸外營養以及其相關并發癥又會給SBS患者帶來很大影響。因此,構建短腸綜合癥大鼠模型有助于深入研究該疾病的發病機制、評估治療方案以及探索新的治療方法。
通常選擇體重在200~300克的雄性大鼠,如Wistar大鼠或Sprague-Dawley大鼠。這些大鼠的消化系統結構與人類相似,且術后恢復較快,適合用于研究腸道適應機制和治療策略。
大鼠在代謝籠中飼養3~5天以適應環境。術前1天給予半流食,術前12小時禁食,但允許少量飲水。術前使用適量的戊巴比妥鈉或異氟醚進行全身麻醉。
在大鼠腹部行縱向正中切口,逐層打開腹腔,切除大約75%的小腸。空腸近端保留約10厘米,回腸末端也保留約10厘米。切除后,將空回腸斷端以絲線間斷縫合,確保吻合口無張力且通暢。
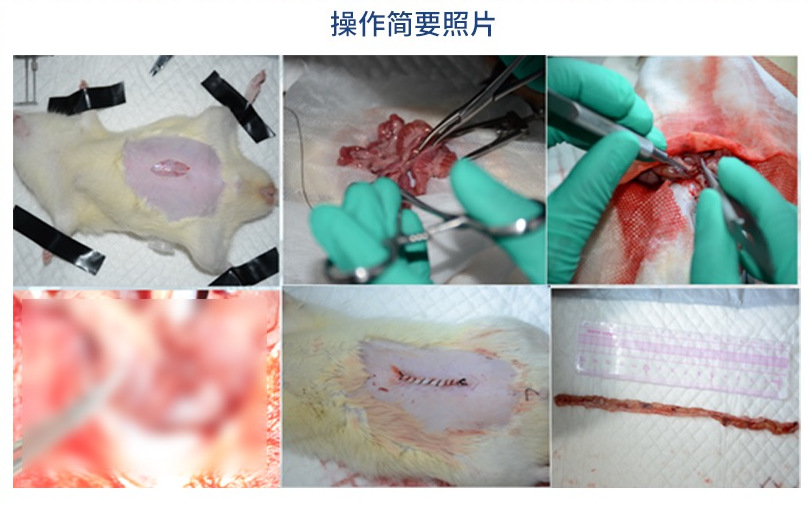

術后通常禁食24小時,避免對腸道產生機械性應激。禁食期間通過腹腔注射或皮下注射補充營養液和生理鹽水。術后可通過皮下注射抗生素(如青霉素)以預防術后感染。
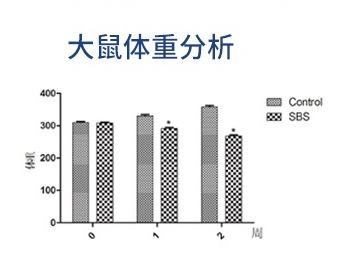
定期監測大鼠的體重和攝食量,評估術后腸道功能變化。術后體重變化是評估SBS模型成功的重要指標。
通過收集和稱量糞便,評估糞便量及水分含量,判斷腸道吸收功能是否受損。短腸綜合癥常伴有腹瀉,因此糞便量和含水量增加是常見現象。
檢測血清中的電解質、總蛋白、白蛋白及肝功能指標,評估腸道吸收障礙對全身營養和代謝的影響。
如測定血漿D-木糖水平以評估小腸吸收能力。
通過HE染色觀察術后腸道黏膜的增厚、絨毛長度及腸腺結構變化,評估腸道再生和適應情況。
通過16S rRNA基因測序或實時定量PCR分析腸道菌群變化,評估短腸綜合癥對腸道微生態的影響。





