一文搞定|從0-1,教你如何做雙熒光素酶實驗?

雙熒光素酶報告基因系統是一種用于研究基因表達調控、蛋白質相互作用和信號通路的常用技術。
該技術誕生于1990年,距今已有30多年的發展史,1993年第一個螢光素酶專利獲批,1996年雙螢光素酶報告基因檢測系統推出,之后廣泛用于生物醫療領域。
該系統通常使用兩種不同的熒光素酶。
目前,以北美螢火蟲(Photinus pyralis)來源的熒光素酶基因和提取自海洋腔腸動物海腎(Renilla reniformis)的熒光素酶應用的最為廣泛。
前者可編碼550個氨基酸的熒光素酶蛋白,是一個62kDa的單體酶,無需表達后修飾,直接具有可被檢測的酶活(張菊梅等, 2001)。
后者也是一種可以催化熒光素發生熒光反應的單亞基特異活性蛋白,其分子量為36kDa;同螢火蟲熒光素酶一樣,該蛋白質在完成轉錄翻譯后即具有催化活性(趙斯斯, 2012)。
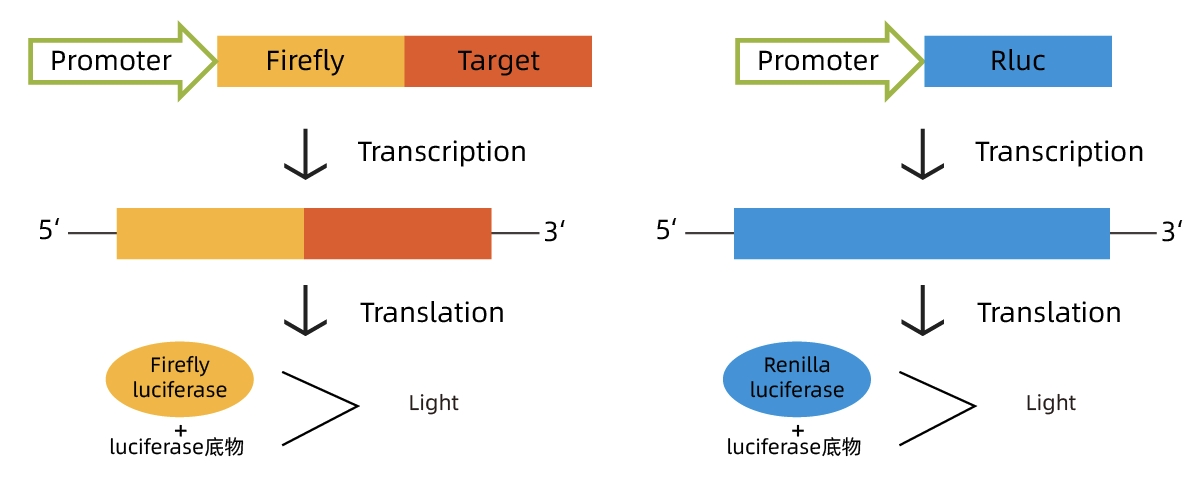
利用熒光素酶與底物結合發生化學發光反應的特性,將感興趣的基因的轉錄調控元件克隆在螢火蟲熒光素酶基因的上/下游,構建成熒光素酶報告質粒。
然后轉染細胞,經適當刺激或處理后裂解細胞,測定熒光素酶活性。通過熒光素酶活性的高低(具體表現為熒光值高低)判斷刺激前后或不同刺激對感興趣的調控元件的影響。
Renilla luciferase的報告基因質粒作為內參,排除不同組之間細胞生長狀況、細胞數目以及轉染效率帶來的干擾,起到校正的作用,從而使實驗結果更為可靠。
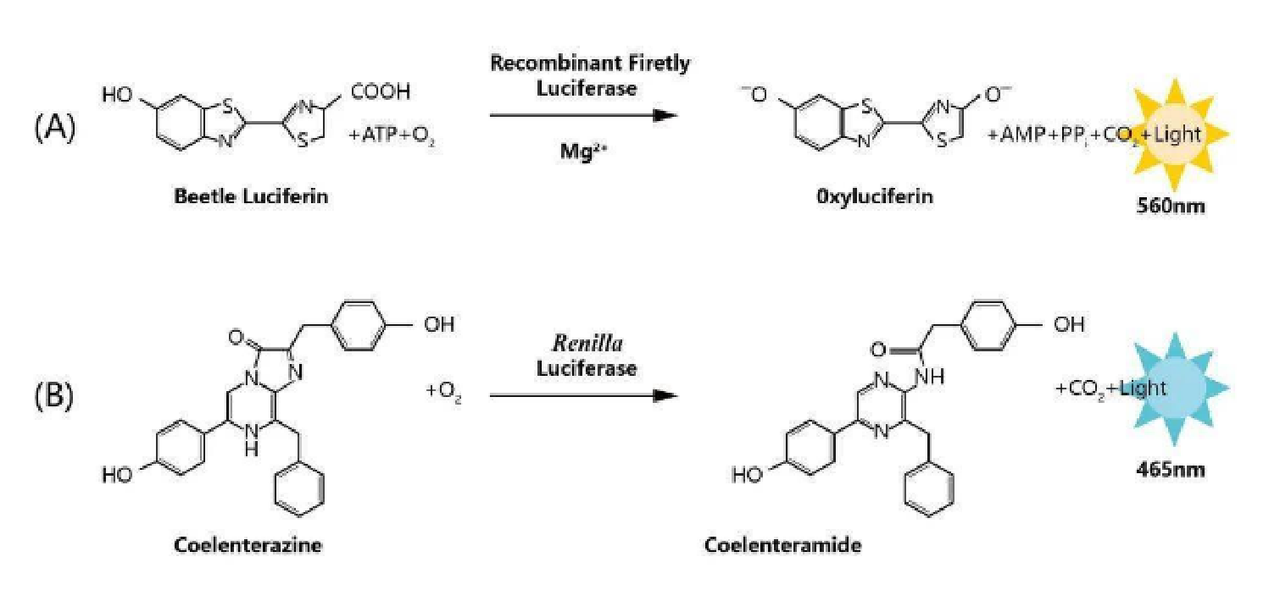
螢火蟲熒光素酶:在ATP、Mg²+及O?的共同參與下,催化熒光素氧化,并發出黃綠色的光芒,發光波長主要在540~600nm。
海腎熒光素酶:在O?參與下,催化腔腸素氧化,發出藍色的光芒,發光波長主要在460~540nm。
目前,常用的F-Luc(螢火蟲熒光素酶)載體大多以pMIR-REPORT載體、pGL3系列載體為主;R-Luc(海腎熒光素酶)載體大多以pRL系列載體為主;
-
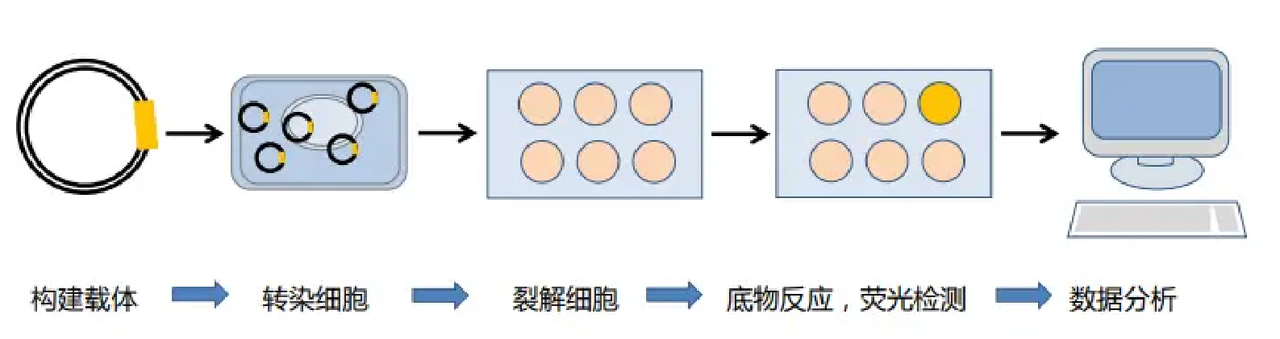
報告基因質粒構建:將目的片段插入到熒光素酶表達的報告基因載體上。
-
轉染細胞:將報告基因質粒和內參質粒共轉染細胞(48h)。
-
細胞處理:根據實驗需要對細胞進行處理。
-
裂解細胞:加入裂解液裂解細胞。
-
測定熒光值:加入底物熒光素,測定螢火蟲熒光素酶和海腎熒光素酶的熒光值。
-
數據處理:計算相對熒光素酶活性,并進行統計分析(如t檢驗或ANOVA)以評估組間差異的顯著性。
插入到熒光基因上游:啟動子序列
插入到熒光基因下游:3’UTR序列
-
miRNA與靶基因的靶向互作研究:驗證miRNA與mRNA、lncRNA、cirRNA互作;CeRNA機制研究;
-
轉錄因子與啟動子互作:研究轉錄因子對基因表達的調控作用;
-
啟動子活性分析:驗證啟動子的表達模式及強度;
-
啟動子SNP分析:一些基因的啟動子區域存在單核苷酸多態性,可運用熒光素酶報告系統分析其相對活性;
-
研究細胞內信號通路的激活和傳導:將特定信號通路的下游響應元件克隆到報告基因載體中,通過測量不同上游條件下熒光素酶活性的變化來評估該信號通路的反應情況;
-
藥物篩選:用于高通量藥物篩選,評估藥物對基因表達的影響;
華聯科擁有成熟的雙熒光素酶報告基因系統和實驗平臺,為您提供量身定制一整套相關技術服務。
服務特點
-
穩定性強:熒光素酶一旦翻譯產生即具有報告活性,且不易降解;
-
特異性強:細胞內無內源性熒光素酶表達,避免了其他因素的干擾;
-
無交叉干擾:兩種熒光素酶反應底物互不干擾,確保了實驗結果的準確性;
-
靈敏度高,比 Western blot 靈敏度高 1000 倍以上;
-
應用范圍廣泛;
-
檢測方便、周期較短;
服務流程
序列評估、靶點預測→基因合成及載體構建→質粒提取→細胞轉染→雙熒光素酶檢測→數據分析
客戶提供
基因:提供詳細的轉錄因子、目的基因、或 microRNA 信息;
細胞:無特殊需求,默認使用 293T 細胞,則無需提供;
交付內容
-
項目結題報告;
-
原始數據(圖片、分析結果等);



